工業スケールでの高い再現性と
環境負荷の低減を可能にする
革新的製造技術
「AJIPHASE®」

AJIPHASE®〈 目 次 〉

病気をより効果的に治療する
治療薬の開発
人類は長らく、病気を治すために薬に依存してきました。しかし、新しい薬が患者に届くまでには、研究開発から臨床試験、規制当局の承認、商業化まで、長い道のりがあります。薬をより円滑に開発するために、製薬会社が薬の製造を第三者に委託することは一般的です。
しかし、臨床試験と商業化の間で製造プロセスが変更されると、薬の安全性を再評価するための時間が必要となり、薬の開発が遅れるリスクが生じます。味の素グループは、この問題を革命的な新しい製造方法であるAJIPHASE®によって解決しています。この独自の技術により、研究開発用の小規模合成から、大規模な量産合成までスケールアップすることが可能になります。
味の素グループのAJIPHASE®技術は、安定した生産を保証することで、革新的な医薬品ができるだけ多くの患者に届くよう支援しています。AJIPHASE®は、味の素株式会社が開発した独自の改善を加えた液相合成技術です。この技術により、高品質な化合物の生産が高いスケーラビリティで可能となります。
アミノ酸技術を医薬品製造に応用する開発の道筋
味の素グループは、アミノ酸技術の分野で100年以上にわたる研究開発を行ってきました。その始まりは、1908年に東京帝国大学(現 東京大学)の池田菊苗博士が、検出した味を伝える結晶を分離したことに遡ります。この結晶は、食品や人体に最も一般的に含まれるアミノ酸の一つであるグルタミン酸で構成されていました。こうして、うま味調味料「味の素®」が誕生しました。それ以来、味の素グループは、アミノ酸の性質や機能に関する継続的な研究を活かして、多様な事業を展開してきました。
1980年代後半、味の素グループは製薬会社が開発した治験薬の重要中間体の製造を開始しました。1990年代には、AIDS、単純ヘルペス、および高血圧の治療に使用される薬の製造に貢献しました。2005年以降、味の素グループはアミノ酸技術をペプチドの合成に応用することを目指してきました。ペプチドは、多くの医薬品の共通成分である複数のアミノ酸の鎖です。そして、これが実現し、ペプチドの実用的な製造プロセスであるAJIPHASE®が開発されました。
固相合成と液相合成の利点を組み合わせた「アンカー」のブレークスルー
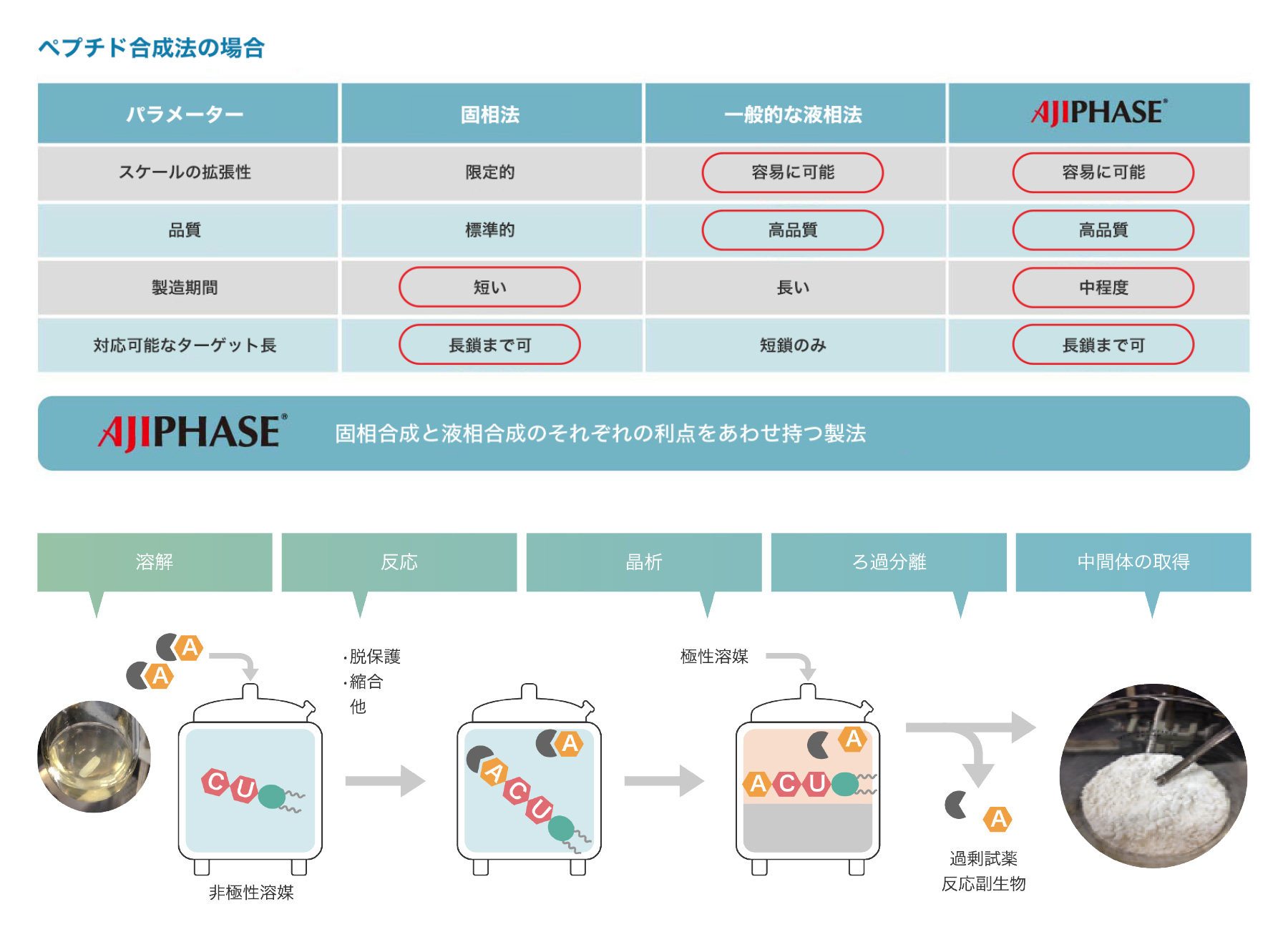
固相合成は、オリゴヌクレオチドやペプチドの合成における主要な製造プロセスとして用いられてきました。固相合成では、固体支持体を充填したカラム内で反応が進行し、試薬や溶媒が流されます。各ステップには通常、残存試薬をカラムから除去するための溶媒洗浄が必要で、複数の反応が必要です。このプロセスは完全に自動化されており迅速ですが、液相合成に比べて試薬や溶媒の消費量が一般的に多くなります。いくつかの制限や欠点を考慮すると、固相合成はスケーラビリティに制限があり、キログラムスケールの合成が限界とされています。
それに対して、AJIPHASE®技術は、反応が進行する有機溶媒に可溶なアンカー支持体を使用します。これにより、システム内の試薬が均一に分布し、固相合成に比べて反応の均質性と効率が向上します。そのため、固相合成とは異なり、AJIPHASE®技術では余分な試薬の消費を抑えることができます。さらに、AJIPHASE®を使用したペプチドおよびオリゴヌクレオチドの製造は、従来のバッチリアクターで行うことができるため、固相合成で必要とされる自動制御用の特殊設備を不要にします。
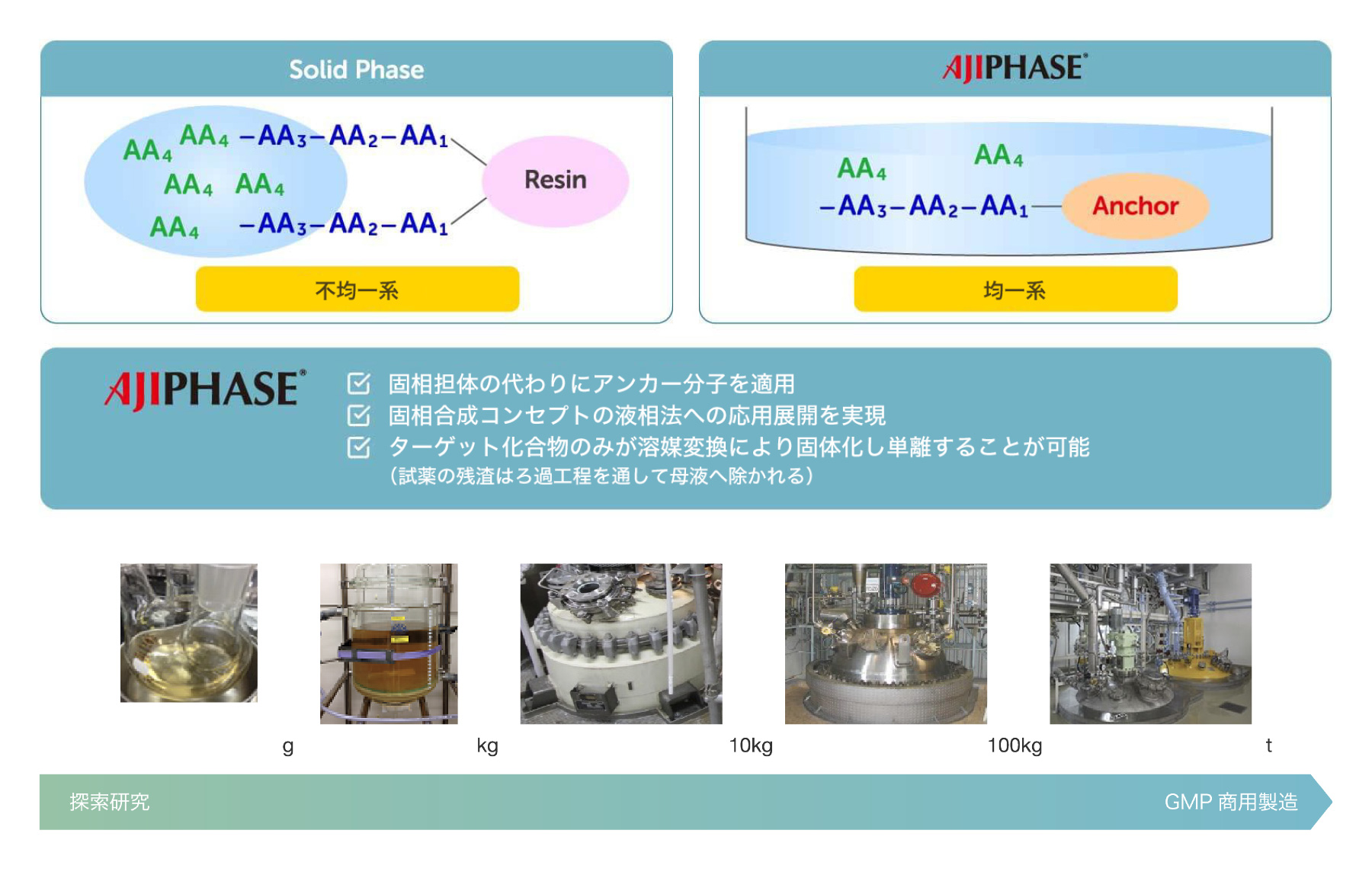
固相合成と液相合成の利点を組み合わせることで、私たちの製造戦略において画期的な進展がもたらされました。特に、特定の有機溶媒には溶けるが他の溶媒には溶けないアンカー支持体の発見により、固相合成で使用される不溶性樹脂ビーズに代わる強力な選択肢が提供されました。目的の粗製品は、バッチリアクターに不溶性溶媒を加えることで容易に沈殿させることができ、沈殿物はろ過によって得られ、反応に使用されたすべての試薬は不良溶媒で単純に洗浄するだけで除去できます。この容易な作業手順は、ペプチドおよびオリゴヌクレオチドの製造において、堅牢で実用的な方法の開発に大きく貢献しました。
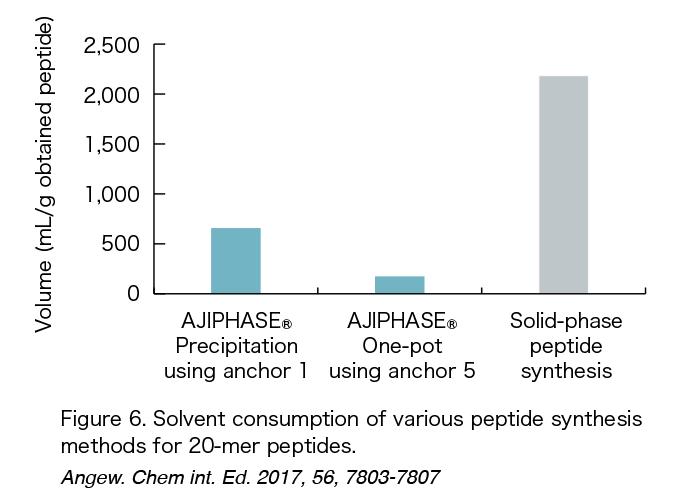
次の段階へ
―核酸医薬品製造への挑戦
すべての薬が同じように機能するわけではありません。治療薬には様々なタイプがあります。近年、核酸医薬品が新しい薬のプラットフォームとして注目を集めています。他の薬が効果を示さなかった病気でも効果がある場合があり、核酸医薬品は製薬・医療分野で期待されています。例えば、先天性筋ジストロフィーに対する効果が期待されています。
タンパク質は最大20種類の異なるアミノ酸を含むペプチド鎖で構成されています。私たちの体は強い筋肉を作るためにタンパク質を生成しますが、筋ジストロフィー患者では、遺伝子の突然変異によって筋肉の機能に必要なジストロフィンタンパク質の生成ができなくなります。ジストロフィンの欠陥により、筋肉が弱くなり、この難病にかかった人々は歩行が困難になります。筋肉の衰弱は幼少期に始まり、運動機能の喪失につながり、重篤な場合には呼吸、嚥下、さらには血液循環の問題を引き起こすこともあります。
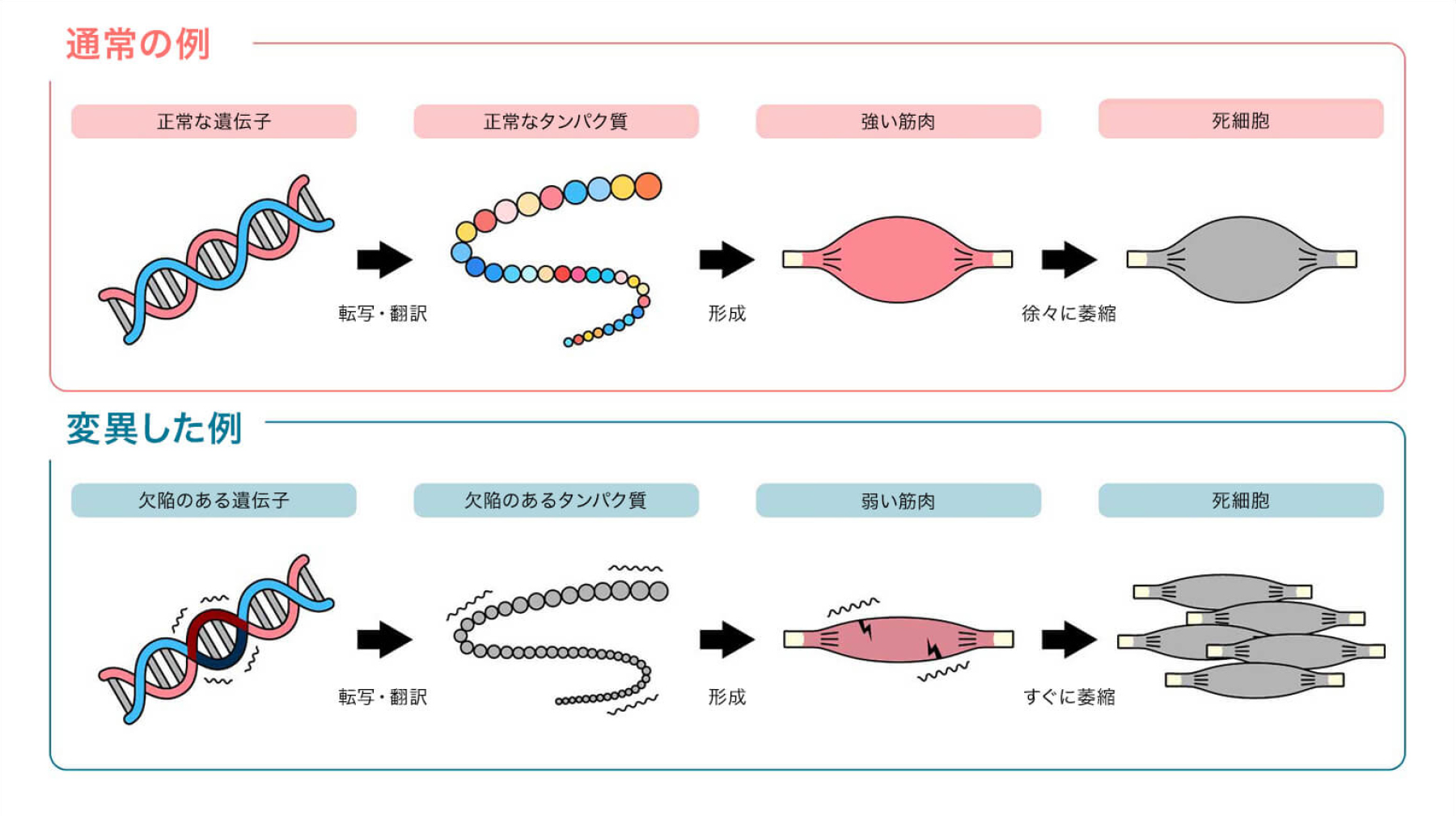
これまでの治療法には、副腎皮質ステロイドを用いて筋細胞の死滅を抑えるための小分子薬や、筋肉量を維持し筋肉の発達を促進するために、筋肉の発達を抑制するタンパク質であるミオスタチンの働きを阻害する抗ミオスタチン療法などがあります。しかし、どちらの治療法も包括的ではありませんでした。一方、核酸医薬品は、RNAにコードされた遺伝情報を制御し、標的タンパク質の機能を抑制するという独自の特性を利用しています。先天性筋ジストロフィーの場合、タンパク質複製時に変異した筋肉遺伝子をスキップすることで、機能的なタンパク質の生成を促進することが可能です。
2011年から、AJIPHASE®技術をモルフォリノの製造に適用し始めました。モルフォリノは人工オリゴヌクレオチドの一種であり、このプロセスはペプチド製造に使用する手法と化学的に類似しています。2015年には、AJIPHASE®技術の次の薬物モダリティとして核酸医薬品の技術開発に新たな段階を迎えました。2020年には、AJIPHASE®プロセスを使用して製造された最初の薬が米国食品医薬品局(FDA)によって承認されました。

過去10年間で、筋萎縮症および筋ジストロフィーの治療に対するオリゴヌクレオチド医薬品のいくつかの承認がなされており、オリゴヌクレオチド医薬品は神経疾患や他の病状の治療に対しても著しい効果を発揮する可能性を秘めています。さらに、オリゴヌクレオチドがCOVID-19のような病気に対するワクチンの有効性を高める可能性が期待されています。対象組織や臓器の範囲を拡大するための研究が進行中であり、核酸製薬業界の将来の成長に大きな可能性を示しています。
味の素グループは、アミノ酸の力を活用し、世界中の人々の健康に貢献することに深くコミットしています。オリゴヌクレオチドやその他の最先端治療法を製薬会社に提供するために、AJIPHASE®技術の進化に向けた研究を絶え間なく続けているだけでなく、薬物提供者や患者にとって最適な技術を提供するための努力も続けています。
What is AJIPHASE®?

Another Innovation Story